近期,山东大学基础医学院赵伟教授团队在抗病毒固有免疫研究中取得新进展,相关研究成果分别以“Viruses hijack FPNl to disrupt iron withholding and suppress host defense”和“Endogenous metabolite N-chlorotaurine attenuates antiviral responses by facilitating IRF3 oxidation”为题,发表于Nature Communications(IF:17.2)和Redox Biology(IF:13.1)杂志。
病毒感染会导致细胞内环境和组织微环境发生各种变化,影响机体对病毒的防御。铁对于宿主及病原微生物均非常重要;独特的氧化还原特性使得铁可以参与代谢、DNA合成等重要生命活动,也可以作为辅助因子赋予蛋白以活性。机体进化出限铁机制(即通过调节细胞内外铁的浓度限制病原微生物对铁的获取)作为抵御入侵微生物的手段。尽管有研究表明限铁机制有利于抑制病原感染,然而针对病毒的限铁机制是否有别于其他病原微生物并不清楚。赵伟教授团队研究发现病毒感染导致细胞内游离Fe2+积累,抑制I型干扰素表达及自噬,从而实现病毒免疫逃逸。机制上,病毒感染诱导宿主E3泛素连接酶DTX3L表达上调,催化细胞膜表面唯一的铁输出蛋白FPN1 K48位泛素化修饰及蛋白酶体途径降解,从而引起Fe2+积累。过量Fe2+进而促进TBK1羟基化修饰及STING羰基化修饰,从而抑制I型干扰素信号通路活化及STING、TBK1依赖的自噬。该研究阐明了病毒感染-细胞内环境-宿主免疫间的互作关系,并为防治病毒性疾病提供了潜在靶点。该研究发表于国际权威期刊Nature Communications,山东大学基础医学院博士生僮丽、汪婕是该文的共同第一作者,赵春媛副教授、赵伟教授为该文的共同通讯作者。

图1. 病毒靶向FPN1破坏限铁机制实现免疫逃逸的模式图
氯化牛磺酸(Tau-Cl)是一种内源性代谢物,在病原体感染过程中大量产生和分泌。然而,其在抗病毒固有免疫中的作用尚不清楚。病毒感染会上调细胞中Tau-Cl水平。Tau-Cl可减弱病毒感染诱导的I型干扰素表达,并增强病毒的复制。从机制上讲,Tau-Cl促进调控I型干扰素转录的关键转录因子IRF3发生氧化修饰,从而抑制IRF3的磷酸化和核转位,并阻断IRF3与IFN-β启动子区的结合。该研究发现Tau-Cl是IRF3介导的抗病毒固有免疫反应的内源性抑制剂,并揭示了病毒通过影响机体组织微环境从而实现免疫逃逸的机制。该研究发表于国际权威期刊Redox Biology,山东大学基础医学院博士生杨亚龙是该文的第一作者,秦颖副研究员为该文的通讯作者。
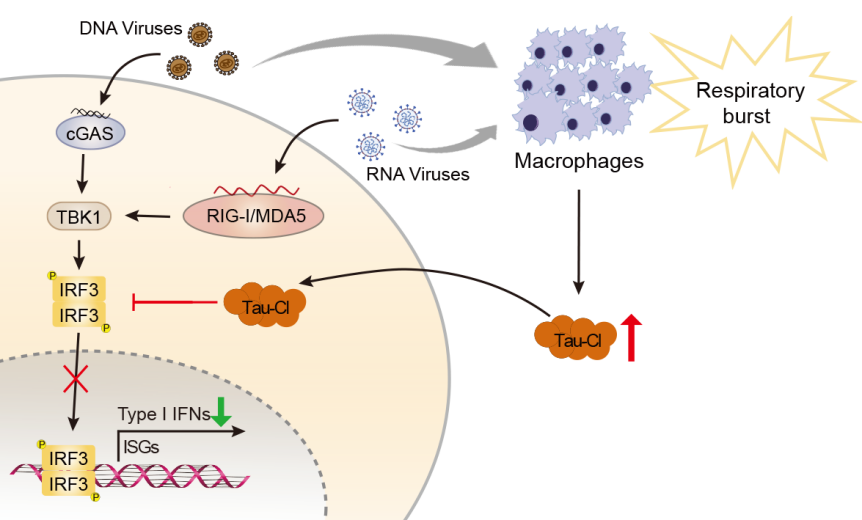
图2. 病毒通过诱导Tau-Cl产生抑制IRF3活化实现免疫逃逸的模式图
赵伟教授团队主要从事抗病毒固有免疫活化和调控机制研究,聚焦病毒感染与机体防御相互作用,揭示病毒免疫逃逸机制和机体炎症风暴的发生机理,为病毒性疾病防治提供理论依据;相关研究成果发表在Immunity、Nature Immunology、Journal of Clinical Investigation、Journal of Experimental Medicine、Nature Communications、Science Advances、PNAS等国际权威杂志。